Invima aprueba uso de emergencia de antiviral contra el COVID-19
Colombia es el primer país suramericano en aprobar el uso de emergencia del molnupiravir.
El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) aceptó la solicitud de Autorización Sanitaria de Uso de Emergencia para el medicamento de síntesis química llamado molnupiravir, desarrollado por la farmacéutica Merck Sharp & Dohme.
El fármaco descubierto en la Universidad Emory de Atlanta (Estados Unidos) y que está siendo desarrollado por la farmacéutica Merck, se desarrolló inicialmente para la gripe, se administra vía oral en una sola cápsula. El molnupiravir inhibe la replicación del SARS-CoV-2, el coronavirus que causa el COVID-19, mediante un mecanismo conocido como mutagénesis letal. (Pfizer y Moderna inician los ensayos clínicos de una vacuna contra la variante ómicron)
“La Sala Especializada (…) emitió concepto recomendando aprobar la solicitud de Asue para el medicamento de síntesis química molnupiravir (Lagevrio) para un grupo específico de pacientes, luego de evaluar la data científica allegada por el interesado, encontrando un balance riesgo-beneficio aceptable en el momento actual de la pandemia, por lo que se aprueba con algunas características especiales para su indicación”, indicó el Invima.
¿Serán de venta libre?
🗞🗞 #Noticia| El antiviral #Molnupiravir, obtiene Autorización Sanitaria de Uso de Emergencia. Este medicamento esta indicado para el tratamiento del la enfermedad, en pacientes confirmados con #COVID19.
➡️https://t.co/pxcIKJAmZ3 ✅✅ pic.twitter.com/NdO2I2BM3Y— Invima (@invimacolombia) January 28, 2022
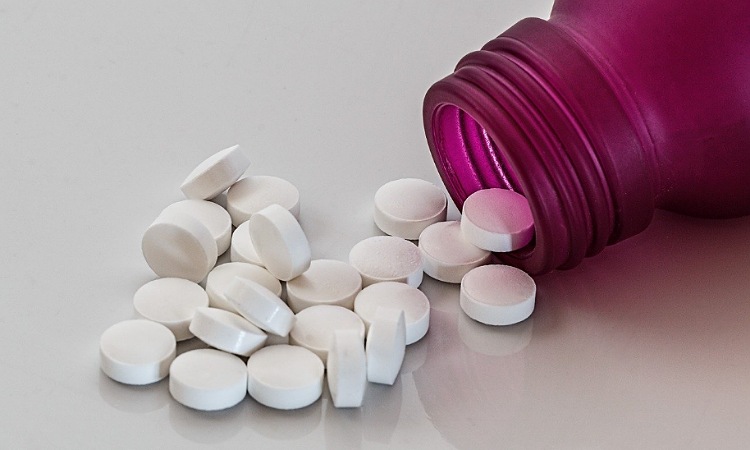
El Invima indicó que las cápsulas serán solamente suministradas bajo fórmula médica a mayores de edad con enfermedad leve o moderada y que no hayan sido vacunados. Cada cápsula contiene 200 mg de molnupiravir y la dosis recomendada es de 800 mg, es decir, cuatro cápsulas de 200 mg cada 12 horas durante 5 días, con o sin alimentos.
La entidad sanitaria de Colombia también explicó que el uso de este medicamento no se recomienda en casos de pacientes con COVID-19 que requieran hospitalización, para iniciar tratamiento posterior a los 5 días de inicio de los síntomas, y tampoco se recomienda su uso en pacientes que hayan presentado previamente la enfermedad. (Colombia llega a 70 millones de vacunas aplicadas)
El medicamento ya se utiliza en otras naciones
El fármaco fue autorizado por los organismos reguladores de EE.UU. y el Reino Unido para tratar a los pacientes de COVID-19 con alto riesgo de enfermedad grave, después de que demostrara una eficacia del 30% en la prevención de la muerte o la hospitalización. El regulador de la Unión Europea todavía está revisando el medicamento.
Si tienes alguna nota positiva que quieras compartir, escríbenos a: tunota@lanotapositiva.com